
CLOLAR 1 MG/ML
CLOFARABINA
Concentrado en solución para infusión
Vial , 20 Mililitros
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de CONCENTRADO contiene 1 mg de clofarabina. Cada vial de 20 ml contiene 20 mg de clofarabina.
Excipientes:
Cada vial de 20 ml contiene 180 mg de cloruro sódico.
INDICACIONES TERAPÉUTICAS: Tratamiento de la leucemia linfoblástica aguda (LLA) en pacientes pediátricos que han presentado una recaída o son refractarios al tratamiento tras haber recibido un mínimo de dos regímenes de tratamiento previos y para los que no existe ninguna otra opción terapéutica con la que se prevea una respuesta duradera. La seguridad y la eficacia del fármaco se han evaluado en estudios con pacientes = 21 años de edad en el momento del diagnóstico inicial (ver Propiedades famacodinámicas).
DATOS FARMACÉUTICOS
Lista de excipientes
• Cloruro sódico
• Agua para preparaciones inyectables
Incompatibilidades: Este medicamento no debe mezclarse con otros excepto con los mencionados en la sección 6.6.
Periodo de validez: 3 años
El concentrado estéril diluido es química y físicamente estable durante 3 días a 2-8ºC y a temperatura ambiente. Desde el punto de vista microbiológico, se debe utilizar de forma inmediata. De no ser así, los tiempos de conservación durante el uso y las condiciones previas al mismo son responsabilidad del usuario y no deben exceder habitualmente las 24 horas a 2-8ºC, a menos que la dilución se haya efectuado en condiciones asépticas controladas y validadas.
Precauciones especiales de conservación: No congelar.
Para las condiciones de conservación del medicamento diluido, (ver Periodo de validez).
Naturaleza y contenido del recipiente: Vial de 20 ml de vidrio de tipo I con tapón de goma de bromobutilo, cápsula de cierre “flip-off” de polipropileno y sellado externo de aluminio. Los viales contienen 20 ml de concentrado estéril y se suministran embalados en una caja. Cada caja contiene 1, 3, 4, 10 o 20 viales.
Posible comercialización solamente de algunos tamaños de envases.
Precauciones especiales de eliminación (y otras manipulaciones): CLOLAR® 1 mg/ml concentrado para solución para infusión se debe diluir antes de su administración.
Se debe hacer pasar a través de un filtro para jeringa estéril de 0,2 micras, para a continuación diluirlo en una solución para infusión intravenosa con 9 mg/ml de cloruro sódico (al 0,9%) hasta obtener el volumen total necesario de acuerdo con los ejemplos proporcionados en la tabla que figura a continuación. No obstante, el volumen de dilución final puede variar en función del estado clínico del paciente y del criterio del médico. (Si no es posible utilizar un filtro para jeringa de 0,2 micras, el concentrado estéril se debe prefiltrar a través de un filtro de 5 micras, diluir y, a continuación, suministrar a través de un filtro de 0,22 micras integrado en la línea de administración).
|
Cuadro de diluciones aconsejadas de acuerdo con la dosis recomendada de 52 mg/m2/día de Clofarabina |
||
|
Área de superficie corporal (m2) |
Concentrado estéril (ml)* |
Volumen total diluido |
|
= 1,44 |
= 74,9 |
100 ml |
|
1,45 a 2,40 |
75,4 a 124,8 |
150 ml |
|
2,41 a 2,50 |
125,3 a 130,0 |
200 ml |
|
*Cada ml de concentrado contiene 1 mg de clofarabina. Cada vial de 20 ml contiene 20 mg de clofarabina. Por lo tanto, en los pacientes con un área de superficie corporal = 0,38 m2, sólo se necesitará parte del contenido de un solo vial para obtener la dosis diaria recomendada de clofarabina. Por el contrario, en los pacientes con un área de superficie corporal > 0,38 m2, se necesitará el contenido de 1 a 7 viales para obtener la dosis diaria recomendada de clofarabina. |
||
El concentrado estéril diluido debe ser una solución clara e incolora. Es preciso inspeccionarla visualmente antes de su administración a fin de descartar la presencia de partículas o de signos de decoloración.
Para un solo uso. Se debe eliminar todo resto de producto no utilizado.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
Se debe obrar conforme a los procedimientos recomendados para la adecuada manipulación de los agentes antineoplásicos. Los medicamentos citotóxicos se deben manipular con precaución.
Se recomienda el uso de guantes desechables y de prendas de protección durante la manipulación de CLOLAR®. Si el producto entra en contacto con los ojos, la piel o las membranas mucosas, enjuague inmediatamente la zona con agua abundante.
Las mujeres embarazadas no deben manipular CLOLAR®.
FORMA FARMACÉUTICA: Concentrado para solución para infusión (concentrado estéril). Solución clara, prácticamente incolora, con un pH de 4,5 a 7,5 y una osmolaridad de 270 a 310 mOsm/l.
PROPIEDADES FARMACOCINÉTICAS
La farmacocinética de clofarabina se estudió en 40 pacientes de edades comprendidas entre 2 y 19 años con LLA o LMA en recaída o refractaria. Se incluyó a los pacientes en un estudio de eficacia y seguridad de fase I (n = 12) o en dos estudios de eficacia y seguridad de fase II (n = 14 / n = 14) y se les administraron dosis múltiples de clofarabina mediante infusión intravenosa (ver Propiedades farmacodinámicas).
|
Farmacocinética en una población de pacientes de 2 a 19 años de edad con LLA o LMA con recaída o refractaria tras la administración de múltiples dosis de clofarabina en infusión intravenosa |
||
|
Parámetro |
Estimaciones basadas en análisis no compartimentales (n = 14 / n = 14) |
Estimaciones basadas en otros análisis |
|
Distribución: |
||
|
Volumen de distribución (estado estable) |
172 l/m2 |
|
|
Unión a proteínas plasmáticas |
47,1% |
|
|
Albúmina sérica |
27,0% |
|
|
Eliminación: |
||
|
Vida media ß de clofarabina |
5,2 horas |
|
|
Vida media de clofarabina trifosfato |
> 24 horas |
|
|
Depuración sistémica |
28,8 l/h/m2 |
|
|
Depuramiento renal |
10,8 l/h/m2 |
|
|
Dosis excretada con la orina |
57% |
|
El análisis multifactorial mostró que la farmacocinética de clofarabina varía en función del peso y que aunque se observó que el recuento leucocitario (RL) influía sobre la farmacocinética de clofarabina, la magnitud de su impacto no era lo suficientemente grande como para individualizar la pauta de dosificación de un paciente de acuerdo con su RL. La infusión intravenosa de 52 mg/m2 de clofarabina generó una exposición equivalente en pacientes con un amplio intervalo de pesos. Sin embargo, la Cmáx es inversamente proporcional al peso del paciente, por lo que en los niños pequeños la Cmáx alcanzada al final de la infusión puede ser mayor que la obtenida en un típico niño de 40 kg al que se le haya administrado la misma dosis de clofarabina por m2. Por consiguiente, se debe considerar el uso de tiempos más prolongados de infusión en los niños de peso < 20 kg (ver Posología y forma de administración).
La eliminación de clofarabina tiene lugar a través de una combinación de excreción renal y de excreción extrarrenal. Alrededor del 60% de la dosis se excreta sin cambios por la orina en un plazo de 24 horas. Las tasas de depuración de clofarabina parecen ser mucho mayores que las tasas de filtración glomerular, lo que sugiere que tanto la filtración como la secreción tubular actúan como mecanismos de eliminación renal. No obstante, dado que no existe un metabolismo detectable de clofarabina por parte del sistema enzimático del citocromo P450 (CYP), las vías de eliminación extrarrenal siguen sin conocerse.
No se observaron diferencias manifiestas en la farmacocinética del fármaco entre los pacientes con LLA y con LMA ni entre varones y mujeres.
No se ha establecido ninguna relación entre la exposición a clofarabina o a clofarabina trifosfato y la eficacia o la toxicidad en esta población.
Poblaciones especiales: Adultos (> 21 y < 65 años de edad): En la actualidad, no se dispone de datos suficientes para establecer la seguridad y la eficacia de clofarabina en los pacientes adultos. No obstante, la farmacocinética de clofarabina en adultos con LMA con recaída o refractaria tras la administración de una sola dosis de 40 mg/m2 en infusión intravenosa a lo largo de 1 hora fue comparable a la previamente descrita en este documento para los pacientes de 2 a 19 años de edad con LLA o LMA con recaída o refractaria tras la administración de 52 mg/m2 de clofarabina en infusión intravenosa a lo largo de un intervalo de 2 horas durante 5 días consecutivos.
Pacientes ancianos (= 65 años): En la actualidad, no se dispone de datos suficientes para establecer la seguridad y la eficacia de clofarabina en los pacientes ancianos.
Pacientes con insuficiencia renal: No hay experiencia con estudios clínicos en pacientes pediátricos con insuficiencia renal (definido en estudios clínicos como creatinina sérica = 2 veces por encima del límite superior de la normalidad para la edad) y clofarabina se excreta predominantemente a través de los riñones (ver Contraindicaciones y Advertencias y precauciones de empleo). Hasta la fecha, se dispone de escasos datos acerca de la farmacocinética de la clofarabina en pacientes pediátricos con depuración de creatinina disminuida. No obstante, estos datos indican que es posible que la clofarabina se acumule en dichos pacientes (ver la siguiente figura, Posología y forma de administración, Advertencias y precauciones de empleo).
Datos farmacocinéticos de poblaciones de pacientes adultos y pediátricos sugieren que los pacientes con insuficiencia renal moderada estable (creatinina sérica 30 - <60mL/min) que recibieron una dosis reducida en un 50%, lograron una exposición similar a la clofarabina que aquellos con función renal normal que recibieron la dosis estándar. El perfil de seguridad de la clofarabina no ha sido establecido en pacientes con insuficiencia renal grave o pacientes en tratamiento de reemplazo renal.
ABC0-24 horas de clofarabina según la depuración de creatinina estimado en condiciones basales en pacientes de edades comprendidas entre 2 y 19 años con LLA o LMA en recaída o refractaria (n = 11 / n = 12) tras la administración de múltiples dosis de clofarabina mediante infusión intravenosa (depuración de creatinina calculada mediante la fórmula de Schwartz)
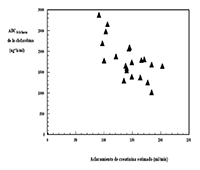
Pacientes con deterioro de la función hepática: No hay experiencia en pacientes con deterioro de la función hepática (bilirrubina sérica > 1,5 veces por encima del límite superior de la normalidad más AST y ALT > 5 veces por encima del límite superior de la normalidad) y el hígado es un posible órgano diana en lo que respecta a efectos tóxicos (ver Contraindicaciones y Advertencias y precauciones de empleo).
PROPIEDADES FARMACODINÁMICAS
Grupo farmacoterapéutico: Agentes antineoplásicos
Código ATC: L01BB06
Este medicamento se ha autorizado en “Circunstancias excepcionales”. Esta modalidad de aprobación significa que debido a la rareza de su enfermedad no ha sido posible obtener información completa de este medicamento.
La Agencia Europea del Medicamento (EMEA) revisará anualmente la información nueva del medicamento que pueda estar disponible y este prospecto se actualizará cuando sea necesario.
Mecanismo de acción: Clofarabina es un antimetabolito nucleósido purínico. Se cree que su actividad antitumoral se debe a 3 mecanismos:
• Inhibición de la ADN polimerasa a, que da lugar a una terminación de la elongación de la cadena de ADN y/o de la síntesis / reparación del ADN.
• Inhibición de la ribonucleótido reductasa, con la consiguiente disminución de los depósitos celulares de desoxinucleótido trifosfato (dNTP).
• Ruptura de la integridad de la membrana mitocondrial, con liberación de citocromo C y de otros factores proapoptóticos que llevan a la muerte programada de la célula, incluso de los linfocitos no proliferativos.
Clofarabina tiene que difundir o ser transportada primero a las células diana, donde las cinasas intracelulares la fosforilan secuencialmente a sus formas mono y difosfato y, finalmente, al conjugado activo, clofarabina 5’-trifosfato. Clofarabina presenta una elevada afinidad por una de las enzimas activadoras de fosforilación, la desoxicitidina cinasa, que incluso supera a la de su sustrato natural, la desoxicitidina.
Además, clofarabina presenta una mayor resistencia a la degradación celular por parte de la adenosina desaminasa y una menor susceptibilidad a la escisión fosforolítica que otros principios activos de su clase, mientras que la afinidad de clofarabina trifosfato por la ADN polimerasa a y por la ribonucleótido reductasa es similar o superior a la de la desoxiadenosina trifosfato.
Efectos farmacodinámicos: Los estudios in vitro han demostrado que clofarabina inhibe el crecimiento celular y que es citotóxica para diversas líneas celulares rápidamente proliferativas, tanto hematológicas como de tumores sólidos. También ha mostrado ser activa frente a macrófagos y linfocitos quiescentes. Además, clofarabina retrasó el crecimiento tumoral y, en algunos casos, provocó la regresión del tumor en una serie de injertos tumorales humanos y murinos implantados en ratones.
Eficacia y seguridad clínicas
Eficacia clínica: A fin de posibilitar la evaluación sistemática de las respuestas observadas en los pacientes, un Panel Independiente de Revisión de las Respuestas (PIRR) que conocía las asignaciones del tratamiento determinó las siguientes tasas de respuesta de acuerdo con las definiciones establecidas por el
|
Grupo de oncología pediátrica: |
|
|
RC = remisión completa |
Pacientes que cumplan todos los siguientes criterios: • Ausencia de blastos circulantes o de datos de enfermedad extramedular • Médula ósea M1 (blastos = 5%) • Recuperación de los recuentos periféricos (plaquetas = 100 x 109/l y RAN = 1,0 x 109/l) |
|
RCp = remisión completa en ausencia de recuperación total de las plaquetas |
• Pacientes que cumplan todos los criterios de RC excepto la recuperación del recuento plaquetario a niveles > 100 x 109/l |
|
RP = remisión parcial |
Pacientes que cumplan todos los siguientes criterios: • Desaparición completa de los blastos circulantes • Médula ósea M2 (blastos = 5% y = 25%) y presencia de células progenitoras normales • Médula M1 que no cumple los criterios de RC o RCp |
|
Tasa de remisión global (RG) |
• (Número de pacientes con RC + Número de pacientes con RCp) ÷ Número de pacientes aptos que recibieron clofarabina |
Se evaluaron la seguridad y la eficacia de clofarabina en un estudio de fase I en régimen abierto, no comparativo y de dosis escalonada, en el que participaron 25 pacientes pediátricos con leucemia recaída o refractaria (17 LLA; 8 LMA) en los que la terapia estándar había fracasado o para los que no existía de otra terapia. La dosis inicial fue de 11,25 con un aumento escalonado a 15, 30, 40, 52 y 70 mg/m2/día, administrados mediante infusión intravenosa durante 5 días cada 2 a 6 semanas, dependiendo de los efectos tóxicos y de la respuesta. A 9 de los 17 pacientes con LLA se les trató con 52 mg/m2/día de clofarabina. De los 17 pacientes con LLA, 2 alcanzaron una remisión completa (12%; RC) y 2 una remisión parcial (12%; RP) en relación con dosis variables. Los efectos tóxicos que limitaron las dosis en este estudio fueron hiperbilirrubinemia, elevación de las concentraciones de transaminasas y exantema maculopapular, cuya aparición tuvo lugar en pacientes tratados con 70 mg/m2/día (2 pacientes con LLA; (ver Sobredosis).
Se realizó un estudio multicéntrico, abierto y no comparativo de fase II con clofarabina para determinar la tasa de remisión global (RG) en los pacientes intensamente pretratados (edad = 21 años en el momento del diagnóstico inicial) con LLA recaída o refractaria definida según la clasificación FAB (franco-americano-británica). Se administró la dosis máxima tolerada según los datos obtenidos en el estudio de fase I, es decir, tal como se ha descrito previamente, 52 mg/m2/día de clofarabina administrados mediante infusión intravenosa durante 5 días consecutivos cada 2 a 6 semanas. En la tabla que figura a continuación se resumen los resultados fundamentales de eficacia de este estudio.
Los pacientes con LLA tenían que cumplir el no haber sido seleccionado para otras terapias de mayor potencial curativo y estar sufriendo al menos una segunda recaída y/o ser refractarios al tratamiento, es decir, no haber alcanzado una remisión tras al menos dos regímenes terapéuticos previos. Antes de su inclusión en el ensayo, 58 de los 61 pacientes (95%) habían recibido de 2 a 4 regímenes de inducción diferentes y 18/61 (30%) de estos pacientes habían sido sometidos a al menos un trasplante previo de células madre hematológicas (TCMH). La mediana de la edad de los pacientes tratados (37 varones, 24 mujeres) era 12 años.
La administración de clofarabina dio lugar a una reducción drástica y rápida de las células leucémicas periféricas en 31 de los 33 pacientes (94%) que tenían un recuento absoluto de blastos medible en condiciones basales. La mediana del tiempo de supervivencia de los 12 pacientes que alcanzaron una remisión global (RC + RCp) era de 66,6 semanas en la fecha de corte para la recolección de datos. Se observaron respuestas en distintos inmunofenotipos de LLA, incluidos los de células pre-B y los de células T. Aunque la tasa de trasplante no era un punto final del estudio, 10/61 pacientes (16%) fueron sometidos a un TCMH tras el tratamiento con clofarabina (3 tras alcanzar una RC, 2 tras una RCp, 3 tras una RP, 1 paciente en el que el PIRR consideró que el tratamiento había fracasado y 1 paciente que el PIRR consideró no evaluable). En los pacientes sometidos a TCMH, existen factores de confusión a la hora de valorar la duración de las respuestas.
|
Resultados de eficacia del estudio fundamental realizado con pacientes (edad = 21 años en el momento del diagnóstico inicial) con LLA con recaída o refractaria tras al menos dos regímenes terapéuticos previos |
||||
|
Categoría de respuesta |
Pacientes de la población por ITT* (n = 61) |
Mediana de la duración de la remisión (semanas) (IC del 95%) |
Mediana del tiempo transcurrido hasta la progresión (semanas)** (IC del 95%) |
Mediana de la supervivencia global (semanas) (IC del 95%) |
|
Remisión global (RC + RCp) |
12 (20%) |
32,0 (9,7 a 47,9) |
38,2 (15,4 a 56,1) |
69,5 (58,6 a -) |
|
RC |
7 (12%) |
47,9 (6,1 a -) |
56,1 (13,7 a -) |
72,4 (66,6 a -) |
|
RCp |
5 (8%) |
28,6 (4,6 a 38,3) |
37,0 (9,1 a 42) |
53,7 (9,1 a -) |
|
RP |
6 (10%) |
11,0 (5,0 a -) |
14,4 (7,0 a -) |
33,0 (18,1 a -) |
|
RC + RCp + RP |
18 (30%) |
21,5 (7,6 a 47,9) |
28,7 (13,7 a 56,1) |
66,6 (42,0 a -) |
|
Fracaso del tratamiento |
33 (54%) |
No procede |
4,0 (3,4 a 5,1) |
7,6 (6,7 a 12,6) |
|
No evaluables |
10(16%) |
No procede |
||
|
Todos los pacientes |
61 (100%) |
No procede |
5,4 (4,0 a 6,1) |
12,9 (7,9 a 18,1) |
|
*ITT = intención de tratar (por su sigla en inglés: Intention to treat). **Los pacientes vivos y en remisión en el momento del último seguimiento se censuraron en dicho momento del tiempo para el análisis. |
||||
|
Datos individuales de la duración de la remisión y supervivencia de pacientes que consiguieron una RC o RCp |
|||
|
Mejor respuesta |
Tiempo hasta la RG (semanas) |
Duración de la remisión (semanas) |
Supervivencia global (semanas) |
|
Pacientes que no recibieron un trasplante |
|||
|
RC |
5,7 |
4,3 |
66,6 |
|
RC |
14,3 |
6,1 |
58,6 |
|
RC |
8,3 |
47,9 |
66,6 |
|
RCp |
4,6 |
4,6 |
9,1 |
|
RC |
3,3 |
58,6 |
72,4 |
|
RCp |
3,7 |
11,7 |
53,7 |
|
Pacientes que recibieron un trasplante mientras continuaban en remisión* |
|||
|
RCp |
8,4 |
11,6+ |
145,1+ |
|
RC |
4,1 |
9,0+ |
111,9+ |
|
RCp |
3,7 |
5,6+ |
42,0 |
|
RC |
7,6 |
3,7+ |
96,3+ |
|
Pacientes que recibieron un trasplante después de un tratamiento alternativo o recaída* |
|||
|
RCp |
4,0 |
35,4 |
113,3+** |
|
RC |
4,0 |
9,7 |
89,4*** |
|
* Duración de la remisión censurada en el momento del trasplante ** Los pacientes se sometieron a trasplante después del tratamiento alternativo *** Los pacientes recibieron un trasplante después de la recaída. |
|||
CONTRAINDICACIONES: Hipersensibilidad a clofarabina o a alguno de los excipientes (ver Lista de excipientes).
Pacientes con insuficiencia renal grave o con deterioro grave de la función hepática.
Se debe interrumpir la lactancia antes, durante y después del tratamiento con CLOLAR® (ver Embarazo y lactancia).
EMBARAZO Y LACTANCIA: No se dispone de datos sobre el uso de clofarabina en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva, incluida teratogenicidad (ver Datos preclinicos sobre seguridad). Clofarabina puede provocar graves defectos natales si se administra durante el embarazo.
Por ello, CLOLAR® no debería utilizarse durante el embarazo, especialmente durante el primer trimestre, excepto si fuese claramente necesario (es decir, sólo cuando el beneficio potencial para la madre sea mayor que el riesgo al que se expone al feto). Si una paciente se queda embarazada durante el tratamiento con clofarabina, es preciso explicarle los posibles riesgos para el feto.
No se sabe si clofarabina o sus metabolitos se excretan en la leche materna humana. No se ha estudiado la excreción de clofarabina a través de la leche en los animales. No obstante, debido a la posibilidad de que se produzcan reacciones adversas graves en los lactantes, la paciente debe dejar de lactar al bebé antes, durante y después del tratamiento con CLOLAR® (ver Contraindicaciones).
Las mujeres en edad de riesgo de embarazo y los varones sexualmente activos tienen que utilizar medidas anticonceptivas eficaces durante el tratamiento. Se han observado efectos tóxicos relacionados con la dosis en los órganos reproductores masculinos de ratones, ratas y perros y en los órganos reproductores femeninos de ratones (ver Datos preclinicos sobre seguridad). Dado que se desconoce el efecto del tratamiento con clofarabina sobre la fertilidad humana, se debe conversar con los pacientes acerca de sus planes reproductivos cuando sea pertinente.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: No se han realizado estudios con clofarabina sobre la capacidad para conducir y utilizar máquinas. No obstante, es preciso advertir a los pacientes de que pueden sufrir efectos adversos tales como mareo, sensación inminente de pérdida del conocimiento o desmayos durante el tratamiento e indicarles que no deben conducir o utilizar máquinas en tales circunstancias.
EFECTOS INDESEABLES: La información proporcionada se basa en los datos obtenidos a partir de una serie de ensayos clínicos en los que 115 pacientes (> 1 y = 21 años de edad) con LLA o leucemia mieloide aguda (LMA) recibieron al menos una dosis de clofarabina a la dosis recomendada de 52 mg/m2 al día x 5.
Los pacientes con LLA o LMA en estadio avanzado pueden sufrir enfermedades concomitantes que confundan y dificulten la evaluación de la causalidad de los eventos adversos debido a la variedad de síntomas relacionados con la enfermedad subyacente, su progresión y la administración concomitante de numerosos medicamentos.
Casi todos los pacientes (98%) sufrieron al menos un evento adverso considerada por el investigador del ensayo como relacionado con clofarabina. Los eventos notificados con más frecuencia fueron náusea (61% de los pacientes), vómitos (59%), neutropenia febril (35%), cefalea (24%), exantema (21%), diarrea (20%), prurito (20%), pirexia (19%), síndrome de eritrodisestesia palmo-plantar (15%), cansancio (14%), ansiedad (12%), inflamación de la mucosa (11%) y rubefacción (11%). Un total de 68 pacientes (59%) sufrieron al menos un evento adverso grave relacionado con clofarabina. Un paciente interrumpió el tratamiento tras recibir 52 mg/m2/día de clofarabina y sufrir una hiperbilirrubinenia de grado 4 que se consideró relacionado con clofarabina.
Tres pacientes fallecieron debido a eventos adversos considerados por el investigador del ensayo como relacionados con el tratamiento con clofarabina: Uno debido a dificultad respiratoria, daño hepatocelular y síndrome de extravasación capilar; otro paciente debido a sepsis por ERV y fallo multiorgánico; y otro paciente debido a choque séptico y fallo multiorgánico.
|
Eventos adversos que se consideraron relacionados con clofarabina y que se comunicaron con una frecuencia = 1/100 (es decir, en >1/115 pacientes) en los ensayos clínicos (Muy frecuentes = = 1/10; frecuentes = = 1/100 a < 1/10) |
|
|
Trastornos de la sangre y del sistema linfático |
Muy frecuentes: Neutropenia febril Frecuentes: Neutropenia |
|
Trastornos cardiacos |
Frecuentes: Derrame pericárdico*, taquicardia* |
|
Trastornos del oído y del laberinto |
Frecuentes: Pérdida de audición |
|
Trastornos gastrointestinales |
Muy frecuentes: Vómitos, diarrea, náuseas Frecuentes: Hematemesis, hemorragias orales, dolor abdominal, dolor en la parte alta del abdomen, hemorragias gingivales, úlceras orales, proctalgia, estomatitis |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes: Pirexia, inflamación mucosa, cansancio Frecuentes: Fallo multiorgánico, dolor, escalofríos, edema, edema periférico, sensación de calor, sensación anormal, síndrome de respuesta inflamatoria sistémica*,irritabilidad |
|
Trastornos hepatobiliares |
Frecuentes: Ictericia, enfermedad venooclusiva, hiperbilirrubinemia, aumento de la alanina aminotransferasa (ALT)* y de la aspartato aminotransferasa (AST)* |
|
Trastornos del sistema inmunológico |
Frecuentes: Hipersensibilidad |
|
Infecciones e infestaciones |
Frecuentes: Choque séptico*, sepsis, bacteriemia, neumonía, herpes zóster, herpes simplex, candidiasis oral |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Frecuentes: Contusión |
|
Exploraciones complementarias |
Frecuentes: Pérdida de peso |
|
Trastornos del metabolismo y de la Nutrición |
Frecuentes: Deshidratación, anorexia, disminución del apetito |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Frecuentes: Dolor en la pared torácica, dolor óseo, dolor de cuello y espalda, dolor en las extremidades, mialgias, artralgias |
|
Neoplasias benignas, malignas y no especificadas (incl. quistes y pólipos) |
Frecuentes: Síndrome de lisis tumoral* |
|
Trastornos del sistema nervioso |
Muy frecuentes: Cefalea Frecuentes: Neuropatía periférica, parestesias, somnolencia, mareo, temblor |
|
Trastornos psiquiátricos |
Muy frecuentes: Ansiedad Frecuentes: Agitación, inquietud, cambios en el estado mental |
|
Trastornos renales y urinarios |
Frecuentes: Hematuria* |
|
Trastornos respiratorios, torácicos y Mediastínicos |
Frecuentes: Taquipnea, epistaxis, disnea, tos, dificultad respiratoria |
|
Trastornos de la piel y del tejido Subcutáneo |
Muy frecuentes: Prurito, síndrome de eritrodisestesia palmo-plantar Frecuentes: Dermatitis exfoliativa, petequias, exantema generalizado, eritema, exantema pruriginoso, alopecia, exantema maculopapular, eritema generalizado, hiperpigmentación cutánea, aumento de sudoración, sequedad de piel |
|
Trastornos vasculares Muy frecuentes: Rubefacción* |
Frecuentes: Hipotensión*, hematomas, síndrome de extravasación capilar |
|
* = Ver más abajo ** En esta tabla se incluyen todos los eventos adversos ocurridos al menos dos veces (es decir, 2 o más eventos (1,7%)). Se han notificado con poca frecuencia casos de síndrome de Stevens Johnson (SSJ) y de necrólisis epidérmica tóxica (NET) en pacientes tratados con clofarabina. |
|
Eventos adversos constituidos por trastornos vasculares: 64 pacientes de 115 (55,7%) sufrieron al menos un evento adverso constituido por un trastorno vascular. Veintitrés pacientes de 115 sufrieron un trastorno vascular considerado como relacionado con clofarabina; los más frecuentemente notificados fueron la rubefacción (13 eventos, ninguno de ellos serio) y la hipotensión (5 eventos, todos ellos considerados serios; (ver Advertencias y precauciones especiales de empleo). No obstante, la mayoría de estos casos de hipotensión se notificaron en pacientes con infecciones graves, que pudieron inducir a confusión.
Eventos adversos constituidos por trastornos cardiacos: El 50% de los pacientes sufrió al menos un evento adverso constituido por un trastorno cardiaco. Se consideraron relacionados con clofarabina 11 eventos ocurridos en 115 pacientes, ninguno de los cuales se consideró serio, siendo el trastorno cardiaco más frecuentemente notificado la taquicardia (35%) (ver Advertencias y precauciones especiales de empleo). El 6,1% (7/115) de las taquicardias de los pacientes se consideraron como relacionados con clofarabina. La mayoría de los eventos adversos cardiacos se notificaron en los 2 primeros ciclos.
Se notificaron como eventos adversos el derrame pericárdico y pericarditis en el 9% (10/115) de los pacientes. Tres de estos eventos se evaluaron posteriormente como relacionados con clofarabina: Derrame pericárdico (2 eventos, 1 de ellos considerado serio) y pericarditis (1 evento que no fue considerado serio). En la mayoría de los pacientes (8/10), el derrame pericárdico y la pericarditis fueron asintomáticos y de nula o escasa significación clínica en la evaluación ecocardiográfica. No obstante, el derrame pericárdico fue clínicamente significativo en 2 pacientes, en los que produjo un cierto grado de compromiso hemodinámico.
Eventos adversos constituidos por infecciones e infestaciones: El 48% de los pacientes tenía una o más infecciones en curso antes de recibir el tratamiento con clofarabina. Un total del 83% de los pacientes sufrió al menos una infección después del tratamiento con clofarabina, incluidas infecciones micóticas, víricas y bacterianas (ver Advertencias y precauciones especiales de empleo). Se consideraron relacionados con clofarabina 21 (18,3%) eventos, de los cuales fueron considerados serios los casos de infección relacionada con un catéter (1 evento), sepsis (2 eventos) y choque séptico (2 eventos; un paciente falleció [ver más arriba]).
Eventos adversos constituidos por trastornos renales y urinarios: Cuarenta y un pacientes de 115 (35,7%) sufrieron al menos un evento adverso constituido por un trastorno renal o urinario. La nefrotoxicidad más frecuente en los pacientes pediátricos fue el aumento de la creatinina.
El aumento de creatinina de grado 3 o 4 se observó en el 8% de los pacientes. Los medicamentos nefrotóxicos, la lisis tumoral y la lisis tumoral con hiperuricemia pueden contribuir a la neurotoxicidad (ver Contraindicaciones y Advertencias y precauciones especiales de empleo). En el 13% de los pacientes totales se observó hematuria. Se consideraron relacionados con clofarabina 4 eventos adversos ocurridos en 115 pacientes, ninguno de los cuales se consideró serio: Hematuria (3 eventos) e insuficiencia renal aguda (1 evento) (ver Contraindicaciones y Advertencias y precauciones especiales de empleo).
Eventos adversos constituidos por trastornos hepatobiliares: El hígado es potencialemente un órgano diana para los efectos tóxicos de clofarabina y el 25.2% de los pacientes sufrió al menos un evento adverso constituido por un trastorno hepatobiliar (ver Contraindicaciones y Advertencias y precauciones especiales de empleo). Se consideraron relacionados con clofarabina 6 eventos, de los cuales se consideraron serios la colecistitis (1 evento), la colelitiasis (1 evento), el daño hepatocelular (1 evento; el paciente falleció [ver arriba]) y la hiperbilirrubinemia (1 evento; el paciente abandonó la terapia [ver arriba]). Se notificaron 2 casos de enfermedad venooclusiva (EVO) en pacientes pediátricos considerados como relacionados con el fármaco del estudio (1,7%).
Además, 50/113 pacientes tratados con clofarabina presentaron al menos una elevación de grado grave (de al menos grado 3 según los CCT del NCI de los EE.UU.) de las concentraciones de ALT, 36/100 una elevación de las concentraciones de AST y 15/114 una elevación de las concentraciones de bilirrubina. La mayoría de las elevaciones de la ALT y la AST tuvieron lugar durante los primeros 10 días de administración de clofarabina y se recuperaban a un grado = 2 en 15 días. Cuando se disponía de datos de seguimiento, la mayoría de las elevaciones de bilirrubina se recuperaban a un grado = 2 en 10 días.
Síndrome de respuesta inflamatoria sistémica (SRIS) o síndrome de extravasación capilar: Se notificó un evento adverso etiquetado como SRIS, síndrome de extravasación capilar (signos y síntomas de liberación de citocinas, por ejemplo, taquipnea, taquicardia, hipotensión, edema pulmonar) en el 5% (6/115) de los pacientes pediátricos (5 con LLA y 1 con LMA) (ver Contraindicaciones y Advertencias y precauciones especiales de empleo).
Se han notificado 13 eventos de síndrome de lisis tumoral, síndrome de extravasación capilar o SRIS: SRIS (2 eventos, ambos considerados serios), síndrome de extravasación capilar (4 eventos, 3 de ellos considerados serios y relacionados con clofarabina) y síndrome de lisis tumoral (7 eventos, 6 de ellos considerados como relacionados con clofarabina y 3 de ellos serios).
Pancreatitis: Durante el tratamiento con clofarabina se han notificado casos de pancreatitis y/o elevaciones de la amilasa y la lipasa séricas.
Experiencia poscomercialización: Las siguientes reacciones adversas han sido identificadas durante el uso de Clorafabina después de su aprobación. Debido a que estas reacciones son reportadas voluntariamente de una población de un tamaño no determinado, no es siempre posible estimar con seguridad su frecuencia o establecer una relación de causalidad con la exposición al medicamento. La decisión para incluir estas reacciones en el inserto está basada principalmente en uno o varios de los siguientes factores: (1) Gravedad de la reacción, (2) Frecuencia reportada de la reacción o (3) Fuerza de la conexión causal con clofarabina.
Infecciones e Infestaciones: Infecciones bacterianas, fúngicas y virales han sido reportadas y pueden ser fatales. Estas infecciones pueden producir choque séptico, falla respiratoria, falla renal y/o falla multi-orgánica.
Trastornos hematológicos y del Sistema Linfático: Citopenias prolongadas (Trombocitopenia, Anemia, Neutropenia y Linfopenia) y falla de médula ósea. Se han presentado sangrados en el contexto de trombocitopenia.
Trastornos Gastrointestinales: Se ha observado hemorragia gastrointestinal y puede estar asociada con desenlaces fatales.
Trastornos Hepatobiliares: Se han reportado graves reacciones adversas hepatotóxicas de la enfermedad veno-oclusiva y pueden ser fatales. La mayoría de los pacientes recibieron tratamientos de acondicionamiento que incluían busulfan, melfalan o la combinación de ciclofosfamida e irradiación corporal total.
Desórdenes del metabolismo y la nutrición: Hiponatremia.
Trastornos dermatológicos y subcutáneos: Casos de Síndrome de Stevens Johnson (SSJ) y necrólisis epidérmica tóxica (NET) han sido reportados en pacientes que estaban recibiendo o han sido tratados recientemente con clofarabina y otros medicamentos (e.g. alopurinol o antibióticos) que se conoce, pueden causar estos síndromes. También se han reportado otras condiciones exfoliativas.
Trastornos Vasculares: Síndrome de extravasación capilar ha sido reportado y puede ser fatal.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN: No se han realizado estudios formales de interacciones con clofarabina hasta la fecha. No obstante, no se conoce ninguna interacción clínicamente significativa de clofarabina con otros medicamentos o pruebas de laboratorio.
No existe un metabolismo detectable del fármaco por parte del sistema enzimático del citocromo P450 (CYP). Por lo tanto, es improbable que interactúe con aquellos principios activos capaces de inducir o inhibir las enzimas del citocromo P450. Además, es improbable que clofarabina produzca una inhibición de cualquiera de las 5 principales isoformas humanas del CYP (1A2, 2C9, 2C19, 2D6 y 3A4) o una inducción de 2 de estas isoformas (1A2 y 3A4) a las concentraciones plasmáticas alcanzadas tras una infusión intravenosa de 52 mg/m2/día. Por consiguiente, no es de esperar que afecte al metabolismo de aquellos principios activos que se sabe son sustratos de estas enzimas.
Clofarabina se excreta predominantemente a través de los riñones y el hígado es un posible órgano diana en lo que respecta a sus efectos tóxicos. Por ello, se debe evitar el uso concomitante de aquellos medicamentos que hayan sido asociados con efectos tóxicos renales, así como de aquellos que se eliminen mediante secreción tubular, especialmente durante el periodo de administración de 5 días del fármaco (ver Advertencia y precauciones especiales de empleo, Efectos indeseables y Propiedades farmacocinéticas). Asimismo, se debe evitar siempre que sea posible el uso concomitante de aquellos medicamentos que hayan sido asociados a efectos tóxicos hepáticos (ver Advertencia y precauciones especiales de empleo y Efectos indeseables).
Durante el tratamiento con clofarabina se debe monitorear estrechamente a aquellos pacientes que estén tomando medicamentos con efectos conocidos sobre la presión arterial o la función cardiaca (ver Advertencia y precauciones especiales de empleo, Efectos indeseables).
DATOS PRECLÍNICOS SOBRE SEGURIDAD: Los estudios toxicológicos con clofarabina en ratones, ratas y perros mostraron que los tejidos rápidamente proliferativos eran los órganos diana primarios en términos de toxicidad.
En las ratas, se observaron efectos cardiacos consistentes en una miocardiopatía y estos efectos contribuyeron a los signos de insuficiencia cardiaca que aparecieron tras varios ciclos repetidos de tratamiento. La incidencia de estos efectos tóxicos dependía tanto de la dosis de clofarabina administrada como de la duración del tratamiento. Se comunicaron en relación con niveles de exposición (Cmáx) aproximadamente 7 a 13 veces (tras 3 o más ciclos de dosificación) o 16 a 35 veces (tras uno o más ciclos de dosificación) mayores que los niveles de exposición clínicos. Los efectos mínimos observados en relación con dosis más bajas sugieren que existe un umbral para la aparición de efectos tóxicos cardiacos y que la farmacocinética plasmática no lineal de la rata puede desempeñar un papel en los efectos observados. Se desconoce el riesgo potencial para los seres humanos.
Se comunicó la presencia de glomerulonefropatía en ratas expuestas a niveles 3 a 5 veces más altos que el ABC clínica, tras la administración de 6 ciclos de clofarabina. Se caracterizaba por un leve engrosamiento de la membrana basal glomerular acompañado de un daño tubular de grado ligero y no se asociaba con cambios en la bioquímica sérica.
Se han observado efectos hepáticos en las ratas tras la administración crónica de clofarabina. Estos efectos probablemente sean el resultado de la superposición de una serie de cambios degenerativos y regenerativos como consecuencia de los ciclos de tratamiento y no se asociaron con cambios en la bioquímica sérica. En los perros, se observaron datos histológicos indicativos de afectación hepática tras la administración aguda de dosis altas, pero no se acompañaron de cambios en la bioquímica sérica.
Se constataron efectos tóxicos relacionados con la dosis sobre los órganos reproductores masculinos en ratones, ratas y perros. Entre estos efectos se encontraban una degeneración bilateral del epitelio seminífero con retención de espermátides y una atrofia de las células intersticiales en ratas sometidas a niveles de exposición muy elevados (150 mg/m2/día), así como una degeneración celular del epidídimo y una degeneración del epitelio seminífero en perros sometidos a niveles de exposición clínicamente relevantes (> 7,5 mg/m2/día de clofarabina).
Asimismo, en las hembras de ratón se constató una atrofia ovárica diferida o una degeneración y apoptosis de la mucosa uterina en relación con la única dosis utilizada de 225 mg/m2/día de clofarabina.
Clofarabina fue teratógena en ratas y conejos. Se comunicó un aumento de las pérdidas postimplantación, una reducción del peso corporal fetal y una disminución del tamaño de las camadas, junto con un aumento del número de malformaciones (malformaciones externas muy evidentes, malformaciones de partes blandas) y de alteraciones esqueléticas (incluida la osificación retardada), en ratas tratadas con dosis que generaban una exposición aproximadamente 2 a 3 veces mayor que la exposición clínica (54 mg/m2/día) y en conejos tratados con 12 mg/m2/día de clofarabina (no se dispone de los datos relativos a la exposición en conejos). Se consideró que el umbral para la aparición de efectos tóxicos sobre el proceso de desarrollo era de 6 mg/m2/día en las ratas y de 1,2 mg/m2/día en los conejos. El nivel de efectos no observables para la toxicidad materna fue de 18 mg/m2/día en las ratas y de más de 12 mg/m2/día en los conejos. No se han realizado estudios de fertilidad.
Los estudios de genotoxicidad demostraron que clofarabina no era mutágena en el ensayo de mutación bacteriana reversa, pero sí indujo efectos clastogénicos en la prueba de aberración cromosómica no activada en las células de ovario de hámster chino y en el ensayo con micronúcleos de rata in vivo.
No se han realizado estudios de carcinogenicidad.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO: CLOLAR® es un potente agente antineoplásico con reacciones adversas hematológicas y no hematológicas potencialmente significativas (ver Efectos indeseables). Por ello, es preciso monitorear estrechamente los siguientes parámetros en los pacientes que estén recibiendo tratamiento con clofarabina:
• Recuentos sanguíneos completos y recuentos plaquetarios completos con regularidad y con mayor frecuencia en aquellos pacientes que desarrollen citopenias.
• Control de la función hepática y renal antes de y durante el periodo de tratamiento activo y después de la terapia. Se debe interrumpir inmediatamente el tratamiento con clofarabina en caso de que se produzca un incremento sustancial de los niveles de creatinina o de bilirrubina.
• Vigilancia del estado respiratorio, la presión arterial, el equilibrio hídrico y el peso durante todo el periodo de 5 días de administración del fármaco e inmediatamente después del mismo.
Se debe evaluar y monitorear a los pacientes en tratamiento con clofarabina a fin de detectar los signos y síntomas indicativos de un posible síndrome de lisis tumoral y de liberación de citocinas (p. ej., taquipnea, taquicardia, hipotensión, edema pulmonar), que pudiera evolucionar hacia un síndrome de respuesta inflamatoria sistémica (SRIS) / síndrome de extravasación capilar o hacia una disfunción orgánica (ver Efectos indeseables). Los pacientes deben recibir líquidos por vía IV durante el periodo de 5 días de administración de clofarabina. El uso de esteroides profilácticos (p. ej., 100 mg/m2 de hidrocortisona los días 1 a 3) puede ser beneficioso para prevenir los signos o síntomas del SRIS o de la extravasación capilar. En caso de que el paciente muestre signos o síntomas tempranos de un SRIS / síndrome de extravasación capilar o de una disfunción orgánica marcada, se
debe suspender inmediatamente el tratamiento con clofarabina e iniciar las medidas de apoyo pertinentes. Se puede considerar la posibilidad de reanudar el tratamiento con clofarabina, generalmente en dosis más bajas, cuando el paciente se haya estabilizado y la función orgánica haya retornado a sus niveles basales.
La mayoría de los pacientes que responden a clofarabina presentan una respuesta tras la administración de 1 o 2 ciclos de tratamiento (ver Propiedades farmacodinámicas). Por consiguiente, es preciso que el médico responsable del tratamiento evalúe los posibles riesgos y beneficios derivados del tratamiento continuado en aquellos pacientes que no presenten una mejoría hematológica y/o clínica tras 2 ciclos de tratamiento.
Durante el tratamiento con clofarabina se debe monitorear estrechamente a los pacientes con enfermedades cardiacas y a aquellos que estén tomando medicamentos con efectos conocidos sobre la presión arterial o la función cardiaca (ver Interacción con otros medicamentos y otras formas de interacción y Efectos indeseables).
No hay experiencia en estudios clínicos en pacientes con insuficiencia renal (definido en estudios clínicos como creatinina sérica = 2 veces por encima del límite superior de la normalidad para la edad) y clofarabina se excreta predominantemente a través de los riñones. Por lo tanto, clofarabina se debe usar con precaución en los pacientes con insuficiencia renal de grado leve a moderado (ver Posología y forma de administración). Hasta la fecha, los datos de los que se dispone acerca de la farmacocinética de clofarabina en los pacientes con depuración de creatinina disminuida no son suficientes para recomendar una reducción de la dosis en dichos pacientes. No obstante, los pocos datos existentes indican que es posible que clofarabina se acumule en los pacientes con depuración de creatinina disminuida (ver Posología y forma de administración y Propiedades farmacodinámicas).
Se debe evitar el uso concomitante de aquellos medicamentos que hayan sido asociados con efectos tóxicos renales o que se eliminen mediante secreción tubular, especialmente durante el periodo de administración de 5 días del fármaco (ver Interacción con otros medicamentos y otras formas de interacción y Efectos indeseables).
No hay experiencia en pacientes con deterioro de la función hepática (bilirrubina sérica > 1,5 veces por encima del límite superior de la normalidad más AST y ALT > 5 veces por encima del límite superior de la normalidad) y el hígado es un posible órgano diana en lo que respecta a efectos tóxicos.
Por lo tanto, clofarabina se debe usar con precaución en los pacientes con deterioro de grado leve a moderado de la función hepática (ver Posología y forma de administración Contraindicaciones). Se debe evitar siempre que sea posible el uso concomitante de aquellos medicamentos que hayan sido asociados a efectos tóxicos hepáticos (ver Interacción con otros medicamentos y otras formas de interacción y Efectos indeseables). Si un paciente experimenta un efecto tóxico hematológico de neutropenia de grado 4 (RAN < 0,5 x 109/l) de una duración =4 semanas, la dosis debe reducirse en un 25% en el ciclo siguiente.
Se debe suspender el tratamiento con clofarabina en todo paciente que presente un efecto tóxico no hematológico grave (de grado 3 según los CCT del NCI de los EE.UU.) por tercera vez, un efecto tóxico grave que no se recupere en un plazo de 14 días (con la excepción de náusea/vómitos) o un efecto tóxico no infeccioso y no hematológico potencialmente mortal o discapacitante (de grado 4 según los CCT del NCI de los EE.UU.) (ver Posología y forma de administración).
Los pacientes que han recibido previamente un trasplante de células madre hematopoyéticas pueden presentar un riesgo más elevado de hepatotoxicidad que sugiera una enfermedad venooclusiva (EVO), tras el tratamiento con clofarabina (40 mg/m2) utilizada en combinación con etopósido (100 mg/m2) y ciclofosfamida (440 mg/m2). Se han notificado varios acontecimientos hepatotóxicos en un estudio de politerapia en fase 1/2 en curso de clofarabina en pacientes pediátricos con leucemia aguda en recaída o refractaria.
Los datos disponibles en la actualidad acerca de la seguridad y la eficacia de clofarabina cuando ésta se administra durante más de 3 ciclos de tratamiento son escasos.
Cada vial de CLOLAR® contiene 180 mg de cloruro sódico. Esto equivale a 3,08 mmol (o 70,77 mg) de sodio y debe tenerse en cuenta en aquellos pacientes que sigan una dieta con contenido restringido de sodio.
FORMA DE ADMINISTRACIÓN: CLOLAR® 1 mg/ml concentrado para solución para infusión se debe diluir antes de su administración (ver Precauciones especiales de eliminación y otras manipulaciones). La dosis recomendada se debe administrar diariamente mediante infusión intravenosa, aunque en los ensayos clínicos en curso se ha administrado a través de un catéter venoso central. CLOLAR® no se debe mezclar con otros fármacos ni suministrar concomitantemente por la misma vía intravenosa utilizada para la administración de otros medicamentos (ver Incompatiblidades).
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN: La terapia debe ser iniciada y supervisada por un médico con experiencia en el tratamiento de pacientes con leucemias agudas.
Adultos (incluidos ancianos): En la actualidad, no se dispone de datos suficientes para establecer la seguridad y la eficacia del tratamiento con clofarabina en los pacientes adultos (ver Propiedades farmacocinéticas).
Pacientes pediátricos: La dosis recomendada es de 52 mg/m2 de superficie corporal al día, administrados mediante infusión intravenosa a lo largo de un intervalo de 2 horas, durante 5 días consecutivos. No hay datos farmacocinéticos de seguridad o eficacia en niños menores de un año, por lo tanto, una dosis recomendada segura y efectiva para pacientes menores de un año no se ha establecido todavía, El área de superficie corporal se debe calcular utilizando el peso y la estatura reales del paciente antes del inicio de cada ciclo.
Los ciclos de tratamiento se deben repetir cada 2 a 6 semanas (contando a partir del día de inicio del ciclo previo) tras la recuperación de la hematopoyesis normal (es decir, recuento absoluto de neutrófilos = 0,75 × 109/l) y de la función orgánica basal. Puede ser necesario disminuir la dosis un 25% en aquellos pacientes que presenten efectos tóxicos significativos. En la actualidad, existe poca experiencia con respecto al tratamiento de pacientes con más de 3 ciclos terapéuticos (ver Advertencias y precauciones especiales de empleo).
La mayoría de los pacientes que responden a clofarabina presentan una respuesta tras la administración de 1 o 2 ciclos de tratamiento (ver Propiedades farmacodinámicas). Por consiguiente, es preciso que el médico responsable del tratamiento evalúe los posibles riesgos y beneficios derivados del tratamiento continuado en aquellos pacientes que no presenten una mejoría hematológica y/o clínica tras 2 ciclos de tratamiento (ver Advertencias y precauciones especiales de empleo).
Clofarabina debe ser diluida antes de la administración. La dosis recomendada debe ser administrada por infusión intravenosa. Clofarabina no debe ser mezclada o concomitantemente administrada utilizando la misma línea intravenosa con otros medicamentos.
Evitar medicamentos con conocida toxicidad renal durante los 5 días de administración de clofarabina. Evitar el uso concomitante de medicaciones con conocida toxicidad hepática.
Niños (de peso < 20 kg): Se debe considerar un tiempo de infusión > 2 horas para ayudar a reducir los síntomas de ansiedad e irritabilidad y a fin de evitar concentraciones máximas, excesivamente elevadas, de clofarabina (ver Propiedades farmacocinéticas)).
Niños (< 1 año de edad): No existen datos sobre la farmacocinética, la seguridad o la eficacia de clofarabina en lactantes. Por lo tanto, todavía no se han establecido las recomendaciones relativas a las pautas de dosificación seguras y eficaces en estos pacientes (<1 año).
Pacientes con insuficiencia renal: La limitada información disponible indica que la Clofarabina puede acumularse en pacientes con depuración de creatinina disminuida (ver Advertencias y precauciones especiales de empleo. Propiedades farmacocinéticas). Clofarabina está contraindicado en pacientes con insuficiencia renal grave (ver Contraindicaciones) y debe ser usado con precaución en pacientes con insuficiencia renal leve a moderada (ver Advertencias y precauciones especiales de empleo).
Pacientes con insuficiencia renal moderada (creatinina sérica 30 - <60mL/min) requieren una reducción del 50% de la dosis, hay información insuficiente para hacer recomendaciones de dosificación en pacientes con daño renal severo (ver Propiedades farmacodinámicas)
Pacientes con deterioro de la función hepática: No hay experiencia en pacientes con deterioro de la función hepática (bilirrubina sérica > 1,5 veces por encima del límite superior de la normalidad más AST y ALT > 5 veces por encima del límite superior de la normalidad) y el hígado es un posible órgano diana en lo que respecta a efectos tóxicos. Por consiguiente, el uso de clofarabina está contraindicado en los pacientes con deterioro grave de la función hepática (ver Contraindicaciones) y dicho fármaco se debe usar con precaución en los pacientes con deterioro de grado leve a moderado de la función hepática (ver Advertencias y precauciones especiales de empleo).
Reducción de la dosis en los pacientes con efectos tóxicos hematológicos: Si el recuento absoluto de neutrófilos (RAN) no se recupera transcurridas 6 semanas desde el inicio de un ciclo de tratamiento, se debe efectuar un aspirado / biopsia de médula ósea a fin de determinar una posible enfermedad refractaria. Si no se encuentran datos de leucemia persistente, se recomienda reducir en un 25% la dosis del siguiente ciclo con respecto a la dosis del ciclo anterior una vez el RAN haya retornado a niveles = 0,75 × 109/l. Si el paciente presenta un RAN < 0,5 × 109/l durante más de 4 semanas (contando a partir del día de inicio del último ciclo), se recomienda reducir en un 25% la dosis del ciclo siguiente.
Reducción de la dosis en los pacientes con efectos tóxicos no hematológicos
Eventos infecciosos: Si un paciente desarrolla una infección clínicamente significativa, se puede interrumpir el tratamiento con clofarabina hasta que la infección se encuentre clínicamente controlada. Una vez controlada, el tratamiento se puede reanudar en dosis completas. En caso de que se produzca una segunda infección clínicamente significativa, se debe interrumpir el tratamiento con clofarabina hasta que la infección esté clínicamente controlada, momento en el que se puede reanudar la administración del fármaco en dosis un 25% más bajas.
Eventos no infecciosos: Si un paciente sufre uno o más efectos tóxicos graves (toxicidad de grado 3 según los Criterios Comunes de Toxicidad [CCT] del National Cancer Institute [NCI] de los EE.UU., con la excepción de náusea y vómitos), el tratamiento se debe retrasar hasta que dichos efectos tóxicos se hayan resuelto y retornado a los valores basales o hasta que dejen de ser de grado grave y el beneficio potencial derivado del tratamiento continuado con clofarabina sea mayor que el riesgo asociado a la continuación del tratamiento. Se recomienda entonces que clofarabina se administre en dosis un 25% más bajas.
En caso de que un paciente sufra un mismo efecto tóxico grave por segunda vez, el tratamiento se debe retrasar hasta que dicho efecto tóxico se resuelva y retorne a los valores basales o hasta que deje de ser de grado grave y el beneficio potencial derivado del tratamiento continuado con clofarabina sea mayor que el riesgo asociado a la continuación del tratamiento. Se recomienda entonces que clofarabina se administre en dosis otro 25% adicional más bajas.
Se debe suspender el tratamiento con clofarabina en todo paciente que presente un efecto tóxico grave por tercera vez, un efecto tóxico grave que no se recupere en un plazo de 14 días (ver excepciones más arriba) o un efecto tóxico que comporte riesgo para la vida o discapacitante (de grado 4 según los CCT del NCI de los EE.UU.) (ver Advertencias y precauciones especiales de empleo).
SOBREDOSIS: No se han descrito casos de sobredosis. No obstante, es de esperar que entre los posibles síntomas de sobredosis se encuentren náuseas, vómitos, diarrea y depresión grave de la médula ósea. Hasta la fecha, la dosis diaria más alta administrada a seres humanos ha sido de 70 mg/m2 durante 5 días consecutivos (2 pacientes pediátricos con LLA). Los efectos tóxicos observados en estos pacientes fueron, entre otros, vómitos, hiperbilirrubinemia, elevación de las concentraciones de transaminasas y exantema maculopapular.
No existe un antídoto específico. Se recomienda suspender inmediatamente la terapia, observar cuidadosamente al paciente e instaurar las medidas de apoyo pertinentes.
PRESENTACIÓN: Vial por 20 ml (Reg. San. INVIMA 2016M-0011769-R1).
CCDS V6
Importado y distribuido por:
SANOFI-AVENTIS DE COLOMBIA S. A.
Transversal 23 No. 97-73, Pisos 8 y 9
Teléfono: 6214400, Fax: 7444237
Bogotá, D.C., Colombia