
SOMATULINE AUTOGEL
LANREÓTIDA
Solución inyectable
1 Jeringa(s) prellenada(s) , Solución inyectable , 60, 90 y 1 Miligramos
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
|
SOMATULINE® AUTOGEL® |
60 mg |
90 mg |
120 mg |
|
Cada JERINGA prellenada de 0,5 ml contiene: |
|||
|
Lanreotida (como acetato) |
60 mg |
90 mg |
120 mg |
|
Ácido acético glacial (para ajuste del pH) |
|||
|
Agua para inyección c.s.p. |
|||
Solución blanca a amarilla pálida, viscosa sobresaturada, en una jeringa prellenada con un sistema automático de seguridad, lista para ser utilizada.
INDICACIONES
— Tratamiento de pacientes con acromegalia en los que el tratamiento quirúrgico y/o la aplicación de radioterapia (tratamientos convencionales) es inadecuado o ineficaz.
— Tratamiento de los síntomas clínicos asociados a los tumores neuroendocrinos (tumores carcinoides, VIPomas: Tumor endocrino péptido intestinal vasoactivo, gastrinomas, glucagonomas, insulinomas), en pacientes adultos.
— Tratamiento de tumores neuroendocrinos gastroenteropancreáticos (GEP-NETs) grado 1 y subconjunto del grado 2 (índice de Ki-67 hasta el 10%); del intestino medio, pancreáticos o de origen desconocido si los sitios del intestino posterior han sido excluidos, en pacientes adultos con enfermedad metastásica o localmente avanzada no resecable. (ver Propiedades Farmacodinámicas).
ACCIÓN TERAPÉUTICA: Clasificación ATC: H01CB: Somatostatina y análogos - H01CB03: Lanreotida.
Grupo Farmacoterapéutico: Inhibidores de la hormona del crecimiento.
PROPIEDADES FARMACOCINÉTICAS: Los parámetros farmacocinéticos de Lanreotida luego de la administración endovenosa en voluntarios sanos, indicaron distribución extravascular limitada, con un volumen de distribución en estado estable de 16,1 l.
La depuración total fue de 23,7 l/h, la vida media terminal de 1,14 horas y el tiempo de vida media fue de 0,68 horas. En los estudios que evaluaron excreción, menos del 5% de Lanreotida se excretó en la orina y menos del 0,5 % se recuperó inalterada en las heces, indicando alguna excreción biliar. Después de la administración subcutánea profunda de SOMATULINE® AUTOGEL® 60, 90 y 120 mg a voluntarios sanos, las concentraciones de Lanreotida aumentan hasta lograr concentraciones séricas máximas promedio de 4,25; 8,39 y 6,79 ng/ml, respectivamente; estos valores de Cmáx se logran durante el primer día después de la administración a las 8, 12 y 7 horas (mediana de los valores). A partir de los niveles séricos máximos, las concentraciones de Lanreotida disminuyen lentamente siguiendo una cinética de primer orden con una vida media de eliminación terminal de 23,3; 27,4 y 30,1 días respectivamente y 4 semanas después de la administración los niveles séricos medios de Lanreotida fueron de 0,9; 1,11 y 1,69 ng/ml respectivamente. La biodisponibilidad absoluta fue de 73,4%; 69,0% y 78,4%.
Después de la administración subcutánea profunda de SOMATULINE® AUTOGEL® 60, 90 y 120 mg a pacientes con acromegalia, las concentraciones de Lanreotida aumentan hasta alcanzar concentraciones séricas máximas promedio de 1,6; 3,5 y 3,1 ng/ml. Estos valores de Cmáx se alcanzaron durante el primer día tras la administración, a las 6, 6 y 24 horas. A partir de los niveles séricos máximos las concentraciones de Lanreotida disminuyen lentamente siguiendo una cinética de primer orden y 4 semanas después de la administración los niveles séricos medios de Lanreotida fueron de 0,7; 1 y 1,4 ng/ml, respectivamente.
Los niveles plasmáticos estables de Lanreotida se alcanzaron, en promedio, después de 4 inyecciones cada 4 semanas. Después de la administración de dosis repetidas cada 4 semanas los valores promedio de Cmáx en estado estable fueron 3,8; 5,7 y 7,7 ng/ml para 60, 90 y 120 mg respectivamente, los valores promedio de Cmín obtenidos fueron de 1,8; 2,5 y 3,8 ng/ml. El índice de variación pico valle fue moderado y osciló entre el 81% y el 108%.
Tras la administración subcutánea profunda de Lanreotida Autogel 60, 90 y 120 mg en pacientes acromegálicos se observaron perfiles lineales de liberación farmacocinética. Los valores séricos de valle de Lanreotida obtenidos tras tres inyecciones subcutáneas profundas de SOMATULINE® AUTOGEL® 60, 90 o 120 mg administrada cada 28 días son similares a los valores séricos de valle en estado estacionario obtenidos en pacientes acromegálicos tratados previamente con administraciones intramusculares de SOMATULINE LP de 30 mg cada 14; 10 o 7 días, respectivamente.
En un análisis PK de población en 290 pacientes GEP-NET que recibían Lanreotida Autogel 120 mg, se observó una liberación rápida inicial con valores medios de Cmáx de 7,49 ± 7,58 ng/mL alcanzados en el primer día tras una sola inyección. Las concentraciones en estado estacionario se alcanzaron tras 5 inyecciones de Lanreotida Autogel 120 mg cada 28 días y se mantuvieron hasta la última evaluación (hasta 96 semanas tras la primera inyección). En el estado estacionario, los valores medios de Cmáx fueron 13,9 ± 7,44 ng/mL y los niveles séricos medios valle fueron 6,56 ± 1,99 ng/mL. La vida media terminal aparente promedio fue de 49,8 ± 28,0 días.
Insuficiencia hepática o renal: Los sujetos con insuficiencia renal severa presentan disminución de aproximadamente 2 veces la depuración sérica total de Lanreotida, con el aumento consiguiente de la vida media y área bajo la curva (AUC). En los sujetos con insuficiencia hepática de moderada a severa, se observó una disminución de la depuración (30%). En sujetos de todos los grados de insuficiencia hepática, el volumen de distribución y el tiempo de vida media aumentaron.
No se observó ningún efecto sobre la depuración de Lanreotida en el análisis PK de población de pacientes con GEP-NET, que incluía 165 con insuficiencia renal leve y moderada (106 y 59 respectivamente) tratados con Lanreotida Autogel. No se estudiaron pacientes con GEP-NET con afectación grave de la función renal.
No se estudiaron pacientes con GEP-NET con insuficiencia hepática (según la puntuación de Child-Pugh).
No es necesario alterar la dosis inicial en pacientes con insuficiencia renal o hepática, ya que se espera que las concentraciones séricas de Lanreotida, en estas poblaciones, estén dentro del rango de concentraciones séricas toleradas con seguridad en sujetos sanos.
Pacientes ancianos: Los sujetos ancianos muestran un aumento en la vida media en comparación con sujetos sanos jóvenes. No es necesario alterar la dosis inicial en ancianos, ya que se espera que las concentraciones séricas de Lanreotida, en esta población, estén dentro del rango de concentraciones séricas toleradas con seguridad en sujetos sanos.
En un análisis PK de población en pacientes con GEP-NETque incluía 122 entre los 65 y los 85 años de edad, no se observó ningún efecto de la edad en la depuración ni en el volumen de distribución de Lanreotida.
PROPIEDADES FARMACODINÁMICAS: Lanreotida es un octapéptido análogo de la somatostatina natural y al igual que la somatostatina, Lanreotida es un inhibidor de diversas funciones endocrinas, neuroendocrinas, exocrinas y paracrinas. Muestra alta afinidad de unión por los receptores de somatostatina humana (SSTR) 2 y 5, y afinidad reducida para los receptores SSTR 1, 3 y 4. La actividad en los receptores SSTR 2 y 5 es el principal mecanismo considerado como responsable de la inhibición de la Hormona del Crecimiento (GH por sus siglas en inglés).
Lanreotida es más activa que la somatostatina natural y presenta mayor duración de acción.
Lanreotida por su actividad inhibidora de la secreción intestinal exocrina y de las hormonas digestivas, se puede utilizar para el tratamiento sintomático de los tumores neuroendocrinos, especialmente de los carcinoides.
Lanreotida, igual que la somatostatina, muestra una acción general exocrina anti-secretora. Inhibe la secreción basal de Motilina, péptido inhibitorio gástrico y polipéptido pancreático, pero no tiene ningún efecto significativo sobre la secreción de secretina o gastrina en ayunas. También disminuye los niveles de cromogranina A plasmática y del ácido 5-hidroxiindolacético urinario (5-HIAA metabolito urinario de serotonina) en los pacientes con GEP-NET y niveles elevados de estos marcadores tumorales. Lanreotida inhibe considerablemente el incremento del flujo sanguíneo de la arteria mesentérica superior y del flujo sanguíneo de la vena porta inducido por los alimentos. Reduce significativamente la secreción yeyunal de agua, sodio, potasio y cloruro estimulada por la prostaglandina E1. Lanreotida reduce los niveles de prolactina en los pacientes con acromegalia con tratamiento prolongado.
En estudios clínicos, los niveles séricos de Lanreotida de 2 ng/ml fueron capaces de suprimir GH hasta < 2,5 ng/ml en más del 59% de los pacientes estudiados. Los niveles séricos de lanreotida de 3,5 ng/ml fueron capaces de suprimir GH hasta < 2,5 ng/ml en más del 81% de los pacientes estudiados.
Se realizó un ensayo clínico fase III, de duración fija de 96 semanas, aleatorizado, doble ciego, multicéntrico, comparativo de Lanreotida Autogel controlado con placebo, en pacientes con tumores neuroendocrinos gastroenteropancreáticos para evaluar el efecto antiproliferativo de Lanreotida.
Los pacientes se aleatorizaron 1:1 para recibir Lanreotida Autogel 120 mg cada 28 días (n=101) o placebo (n=103).La aleatorización fue estratificada por terapia previa al inicio y la presencia o ausencia de progresión basal evaluada según RECIST versión 1.0 (Criterios de Evaluación de Respuesta en Tumores Sólidos) durante una fase de investigación de 3 a 6 meses.
Los pacientes tenían enfermedad inoperable localmente avanzada y/o metastásica con tumores moderadamente bien diferenciados o bien confirmados histológicamente, localizados principalmente en el páncreas (44,6% de los pacientes), en el intestino medio (35,8%), en el intestino posterior (6,9%) o de otra/desconocida localización principal (12,7%). El 69% de los pacientes con GEP-NETs tenían tumor grado 1 (G1) definido por el índice de proliferación Ki67 = 2% (50,5% de la población total de pacientes) o por el índice mitótico < 2mitosis/10HPF (18,5% de la población total de pacientes) y el 30% de los pacientes con GEP-NETs tenían tumores en el rango inferior del grado 2 (G2: Definido por 2% < índice Ki67 = 10%). El grado del tumor no estuvo disponible en el 1% de los pacientes. El estudio excluyo a los pacientes con GEP-NETs G2 con índice de proliferación celular alto (10% < índice Ki67 = 20%) y carcinomas neuroendocrinos GEP G3 (índice Ki67>20%).
En general el 52,5% de los pacientes tenían una carga tumoral hepática = 10%, el 14,5% tenían una carga tumoral hepática >10 y = 25% y el 33% de los pacientes con carga tumoral hepática > 25%.
El criterio de valoración principal fue la sobrevida libre de progresión (PFS por sus siglas en inglés) medida como el tiempo hasta la progresión por RECIST 1.0 o la muerte durante las 96 semanas posteriores a la primera administración del tratamiento. El análisis PFS, se realizó mediante evaluación radiológica de la progresión de la enfermedad.
|
Tabla 1. Resultados de eficacia del estudio de fase III |
||||
|
Mediana de la sobrevida libre de progresión |
Hazard Ratio (IC 95%) |
Reducción en el riesgo de progresión o muerte |
Valor p |
|
|
Lanreotida Autogel (n=101) |
Placebo (n=103) |
|||
|
> 96 semanas |
72,00 semanas IC 95%: 48,57 a 96,00 semanas |
0,470 (0,304; 0,729) |
53% |
0,0002 |
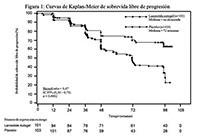
El efecto benéfico de Lanreotida para reducir el riesgo de progresión o muerte fue consistente e independiente de la localización del tumor primario, la carga tumoral hepática, la quimioterapia previa, el Ki67 basal, el grado del tumor y otras características predeterminadas, como se representa en la Figura 2.

Un beneficio clínicamente relevante del tratamiento con Lanreotida Autogel se observó en pacientes con tumores de origen pancreático, del intestino medio y de otro/desconocido así como en la población total del estudio. El número limitado de pacientes con tumores del intestino medio (14/204) dificultó la interpretación de los resultados en este subgrupo. Los datos disponibles sugieren que no hay beneficio de la Lanreotida en estos pacientes.
Finalizado este estudio se realizó el estudio de extensión de etiqueta abierta en el que ingresaron 45,6 % de los pacientes pertenecientes al grupo placebo.
Un ensayo clínico realizado en pacientes con acromegalia bien controlados con Somatuline 30 mg cada 14 o 10 días mostró que la administración de SOMATULINE® AUTOGEL® 120 mg cada 56 o 42 días no es inferior al régimen inicial de administración, según la evaluación de los niveles de Hormona del crecimiento.
En un estudio fase IIIb, abierto, de un brazo, se administró SOMATULINE® AUTOGEL® 120 mg cada 28 días durante 48 semanas en 90 pacientes acromegálicos diagnosticados con macroadenoma pituitario sin tratamiento previo. A la semana 48 se observó una reducción del tumor = 20% en el 62.9% de los pacientes IC 95: 52%-73%), el porcentaje medio de reducción del volumen tumoral fue del 26,8%, los niveles de hormona del crecimiento fueron inferiores a 2,5µg/l en el 77,8% de los pacientes y los niveles de IGF-1 se normalizaron en el 50%. En el 43,5% de los pacientes se observaron niveles normalizados de IGF-1 con niveles de hormona del crecimiento por debajo de 2,5 µg/l. Hasta el 68.5% de los pacientes presentaron mejoría de los síntomas derivados de la acromegalia como fatiga, sudoración excesiva, artralgia o hinchazón de tejidos blandos. A partir de la semana 12, se observó una temprana reducción tanto del volumen tumoral como de los niveles de hormona del crecimiento y de IGF-1 que se mantuvo en el tiempo. El estudio excluyó los pacientes en espera de recibir cirugía pituitaria o radioterapia durante el periodo del estudio.
Población pediátrica: La Agencia Europea de Medicamentos ha exonerado de la obligación de presentar los resultados de estudios con Lanreotida Autogel en todas las subpoblaciones pediátricas en acromegalia y gigantismo pituitario (consulte la sección de Posología- Niños y adolescentes). La Agencia Europea de Medicamentos ha incluido los tumores neuroendocrinos gastroenteropancreáticos (excepto neuroblastoma, neuroganglioblastoma, feocromocitoma) en la lista de clases exoneradas.
CONTRAINDICACIONES: Hipersensibilidad a Lanreotida, a los péptidos relacionados o a cualquiera de los excipientes de SOMATULINE® AUTOGEL®.
EMBARAZO Y LACTANCIA
Embarazo
Datos preclínicos: Los estudios en animales no mostraron evidencias de efectos teratogénicos asociados a Lanreotida durante la organogénesis. En ratas hembras se ha observado reducción de la fertilidad, debido a la inhibición de la secreción de GH a dosis que exceden las dosis terapéuticas alcanzadas en humanos.
Datos clínicos: Los datos de un número limitado de mujeres embarazadas expuestas al medicamento, no indican efectos adversos de Lanreotida en el embarazo, ni sobre la salud del feto/neonato. Hasta la fecha, no se dispone de otros datos epidemiológicos relevantes.
No existen datos adecuados con respecto al uso de Lanreotida en mujeres embarazadas. Los estudios realizados en animales han demostrado mayor pérdida pre y post-implante pero no hay evidencia de efectos teratogénicos asociados con Lanreotida durante la organogénesis. Se desconoce el riesgo potencial para humanos.
Debido a que los estudios en animales no siempre predicen la respuesta humana, Lanreotida debe administrarse a mujeres embarazadas solo si es claramente necesaria y quedará a discreción del médico tratante la evaluación del riesgo-beneficio.
Lactancia: No se sabe si Lanreotida se excreta a través de la leche materna. Por lo tanto las mujeres tratadas con Lanreotida no deben amamantar.
Fertilidad: En ratas hembras, se observó disminución de fertilidad secundaria a la inhibición de la secreción de GH a dosis excesivas no administradas en humados a dosis terapéuticas.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: Aunque no se ha determinado ningún efecto en la capacidad de conducir y usar maquinaria, sí se han informado mareos con Somatuline Autogel. Si un paciente está afectado, él/ella no debe conducir ni operar maquinaria.
EFECTOS ADVERSOS: Los efectos indeseados informados por pacientes con acromegalia y GEP-NET tratados con Lanreotida en estudios clínicos se listan según los correspondientes sistemas y órganos de acuerdo con la siguiente clasificación: Muy comunes (=1/10); Comunes (=1/100 a <1/10); Poco comunes (=1/1.000 a <1/100).
Las reacciones adversas a medicamentos más comúnmente esperadas tras el tratamiento con Lanreotida son los trastornos gastrointestinales (los que más suelen informarse son diarrea y dolor abdominal, usualmente leves o moderados y transitorios), colelitiasis (generalmente asintomática) y reacciones en el sitio de inyección (dolor, nódulos e induración).
El perfil de efectos indeseados es similar para todas las indicaciones.
|
Clasificación por sistemas |
Muy Comunes (=1/10) |
Comunes (=1/100 a <1/10) |
Poco comunes (=1/1000 a <1/100) |
Experiencia de seguridad post-comercialización (Frecuencia Desconocida) |
|
Investigaciones complementarias |
ALAT elevada*, ASAT anormal*, ALAT anormal*, bilirrubina sanguínea elevada*, glucemia elevada*, hemoglobina glicosilada elevada, peso disminuido, enzimas pancreáticas disminuidas** |
ASAT elevada* , fofatasa alcalina sanguínea elevada*, bilirrubina sanguínea anormal* , sodio sanguíneo disminuido* |
||
|
Trastornos cardiacos |
Bradicardia sinusal* |
|||
|
Trastornos del sistema nervioso |
Mareos, dolor de cabeza, letargia** |
|||
|
Trastornos gastrointestinales |
Diarrea, heces blandas*, dolor abdominal |
Náusea, vómito, estreñimiento, flatulencia, distensión abdominal, malestar abdominal, dispepsia, esteatorrea** |
Heces decoloradas* |
Pancreatitis |
|
Trastornos de la piel y del tejido subcutáneo |
Alopecia, hipotricosis* |
|||
|
Trastornos del metabolismo y de la nutrición |
Hipoglucemia, apetito disminuido**, hiperglucemia, diabetes mellitus |
|||
|
Trastornos vasculares |
Sofocos* |
|||
|
Trastornos generales y alteraciones en el sitio de administración |
Astenia, fatiga, reacciones en el sitio de inyección (dolor, masa, induración, nódulo, prurito) |
|||
|
Trastornos hepatobiliares |
Colelitiasis |
Dilatación biliar* |
||
|
Trastornos psiquiátricos |
Insomnio* |
|||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Dolor musculoesquelético**, mialgia** |
|||
|
Trastornos del sistema inmunológico |
Reacciones alérgicas (incluyendo angioedema, anafilaxis, hipersensibilidad) |
|||
|
* Con base en un conjunto de estudios realizados con pacientes acromegálicos ** Con base en un conjunto de estudios realizados con pacientes con GEP-NET |
||||
INTERACCIÓN CON OTROS PRODUCTOS MEDICINALES Y OTRAS FORMAS DE INTERACCIÓN: Los efectos farmacológicos gastrointestinales de SOMATULINE® AUTOGEL® pueden ocasionar la reducción de la absorción intestinal de medicamentos administrados de forma concomitante.
La administración concomitante de ciclosporina con Lanreotida puede disminuir la biodisponibilidad relativa de la ciclosporina y, por lo tanto, se puede necesitar del ajuste de la dosis de ciclosporina para mantener los niveles terapéuticos.
Las interacciones con compuestos altamente unidos al plasma son poco probables teniendo en cuenta la unión moderada de la Lanreotida a las proteínas séricas (unión sérica promedio de 78%).
Los datos publicados limitados indican que la administración concomitante de análogos de somatostatina y bromocriptina puede aumentar la disponibilidad de la bromocriptina.
La administración concomitante de fármacos que induzcan bradicardia (p.ej., betabloqueadores) puede tener un efecto aditivo sobre la reducción leve de la frecuencia cardiaca asociada a la Lanreotida. Puede ser necesario ajustar la dosis de tales medicamentos concomitantes.
Los datos publicados limitados indican que los análogos de la somatostatina podrían reducir la depuración metabólica de los compuestos conocidos que son metabolizados por las enzimas del citocromo P450, lo cual puede deberse a la supresión de la hormona del crecimiento. Puesto que no es posible descartar que la Lanreotida pueda tener este efecto, otros fármacos principalmente metabolizados por CYP3A4 y que posean un bajo índice terapéutico (por ejemplo, quinidina, terfenadina) deben utilizarse entonces con precaución.
DATOS PRECLÍNICOS DE SEGURIDAD: En los ensayos biológicos carcinogénicos realizados en ratas y ratones, no se observó ningún cambio neoplásico sistémico a dosis por encima de las dosis terapéuticas alcanzadas en humanos. Se observó una incidencia incrementada de tumores subcutáneos en los sitios de inyección, probablemente debido a la mayor frecuencia de dosis en animales (diaria) comparada a la dosis mensual en humanos. Por lo tanto, puede no ser clínicamente relevante.
En las baterías de ensayos in vitro e in vivo, Lanreotida no mostró ningún potencial genotóxico.
Se observó toxicidad embrio/fetal en ratas (mayor pérdida pre-implante) y en conejos (mayor pérdida post-implante). Los estudios realizados en animales mostraron un retraso transitorio en el crecimiento de las crías antes del destete.
PRECAUCIONES Y ADVERTENCIAS ESPECIALES PARA SU USO: Lanreotida puede reducir la motilidad de la vesícula biliar y conllevar a la formación de cálculos biliares. La litiasis biliar, es generalmente asintomática, por lo tanto, se recomienda realizar una ecografía de la vesícula antes de iniciar el tratamiento y periódicamente cada seis meses, de ahí en adelante, en tratamientos prolongados. Los cálculos sintomáticos deben tratarse según lo indicado clínicamente.
Los estudios de farmacología animal y humana demuestran que Lanreotida, como la somatostatina y sus análogos, inhibe la secreción de insulina y de glucagón. Por lo tanto, los pacientes tratados con SOMATULINE® AUTOGEL® pueden experimentar hipoglucemia o hiperglucemia. Los niveles de glucosa en sangre deben monitorearse de manera estricta cuando se inicia el tratamiento con Lanreotida o cuando se modifica la dosis. En pacientes diabéticos no insulino-dependientes, debe realizarse un monitoreo estricto de la glucemia durante el tratamiento. En los pacientes diabéticos insulino-dependientes, los requerimientos de insulina se pueden reducir (inicialmente un 25%) y luego la dosis debe ser ajustada según corresponda, de acuerdo con los niveles de glucemia.
Se han observado disminuciones leves de la función tiroidea durante el tratamiento con Lanreotida en pacientes con acromegalia, si bien el hipotiroidismo clínico es poco común (<1%). Se deben realizar exámenes de la función tiroidea cuando se indique clínicamente.
En pacientes con problemas cardiacos subyacentes, Lanreotida puede llevar a una disminución de la frecuencia cardiaca sin alcanzar necesariamente el umbral de bradicardia (<60 latidos por minuto). Los pacientes que sufren de trastornos cardiacos, antes de iniciar la administración de Lanreotida, pueden presentar bradicardia sinusal y por lo tanto debe controlarse la frecuencia cardiaca. Se debe tener precaución al iniciar el tratamiento en pacientes con bradicardia.
Si se aumenta la esteatorrea durante el tratamiento, es aconsejable complementarlo con extractos pancreáticos.
FORMA DE ADMINISTRACIÓN: SOMATULINE® AUTOGEL® debe ser inyectada por vía subcutánea profunda en el cuadrante superior externo del glúteo por profesionales de la salud.
Para los pacientes tratados por acromegalia o por síntomas asociados con NET que reciben dosis estables de SOMATULINE® AUTOGEL® y luego de una capacitación apropiada por parte de profesionales de la salud, el producto puede ser administrado ya sea por vía subcutánea profunda en la parte superior externa del muslo por el paciente o bien por vía subcutánea profunda en el cuadrante superior externo del glúteo por una persona capacitada.
La decisión de la administración por parte del paciente o de una persona capacitada debe ser adoptada por el profesional de la salud.
Independientemente del sitio de inyección, no debe pellizcarse la piel y la aguja debe insertarse rápida y totalmente, en forma perpendicular a la piel. El sitio de la inyección se debe alternar entre el lado derecho y el izquierdo.
INSTRUCCIONES DE USO
POR FAVOR, LEA TODAS LAS INSTRUCCIONES DETENIDAMENTE ANTES DE COMENZAR A APLICAR LA INYECCIÓN.
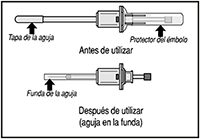
SOMATULINE® AUTOGEL® se suministra en una jeringa prellenada lista para su uso con un sistema automático de seguridad que bloquea la aguja automáticamente después de la administración del producto, para evitar posibles lesiones después de su utilización.
1. Retire SOMATULINE® AUTOGEL® del refrigerador/heladera 30 minutos antes de su administración. Mantener el sobre cerrado hasta el momento de aplicar la inyección.
2. Antes de abrir el sobre, compruebe que esté intacto y que el medicamento no haya vencido. La fecha de vencimiento está impresa en la caja de cartón externa y en el sobre.
NO UTILIZAR SI EL MEDICAMENTO ESTÁ VENCIDO O SI EL SOBRE PROTECTOR ESTÁ DAÑADO DE ALGUNA MANERA.
3. Lávese las manos con jabón y asegúrese de disponer de un área limpia para la preparación.
4. Abra el sobre y saque la jeringa prellenada.
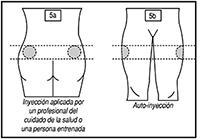
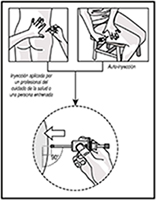
5. Seleccione un sitio de inyección:
a. El cuadrante superior externo del glúteo (si la inyección la aplica un profesional de la salud o una persona previamente capacitada), o
b. La parte superior externa del muslo (en caso de que Usted mismo se aplique la inyección).
• Alterne el sitio de la inyección entre el lado derecho y el lado izquierdo cada vez que reciba una inyección de SOMATULINE® AUTOGEL®
6. Desinfecte el sitio de la inyección.
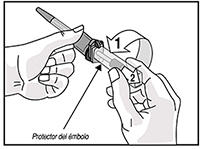
7. Gire y retire el protector del émbolo y deséchelo.
8. Retire la tapa de la aguja y deséchela.
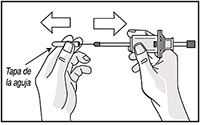
9. Mantener la piel tirante alrededor del sitio de la inyección utilizando el pulgar y el índice. Sin plegar ni presionar la piel en el sitio de la inyección, inserte rápidamente la aguja en toda su longitud (inyección subcutánea profunda), de forma perpendicular a la piel.
10. Inyecte el fármaco lentamente. Suelen ser necesarios 20 segundos.
Inyectar toda la dosis hasta que el émbolo llegue hasta el final. En este punto, usted oirá un “clic”.
Nota: Mantenga la presión sobre el émbolo con el pulgar para evitar la activación del sistema automático de seguridad.
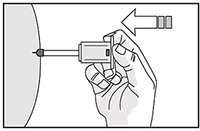
11. Sin dejar de presionar el émbolo con el pulgar, retire la aguja del sitio de la inyección.
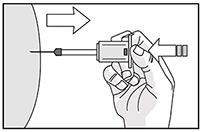
12. Luego deje de presionar sobre el émbolo. La aguja se retraerá automáticamente dentro de la funda donde quedará bloqueada en forma permanente.
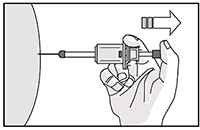
13. Aplique una leve presión en el sitio de la inyección con un algodón seco o una gasa estéril para evitar un posible sangrado. No frotar ni masajear el sitio de la inyección después de la administración.
14. Deseche la jeringa utilizada de acuerdo con las instrucciones del médico o del personal sanitario. NO arroje el dispositivo a la basura.
Cualquier producto no usado o material de desecho debe desecharse según las exigencias locales.
POSOLOGÍA
Tratamiento de la acromegalia: La dosis recomendada inicial es de 60 a 120 mg, administrados cada 28 días.
En general, en los pacientes tratados anteriormente con Somatuline 30 mg con una dosis cada 14 días, la dosis inicial de SOMATULINE® AUTOGEL® debe ser de 60 mg cada 28 días, y en los pacientes tratados anteriormente con Somatuline 30 mg con una dosis cada 10 días, la dosis inicial de SOMATULINE® AUTOGEL® debe ser 90 mg cada 28 días. Alternativamente, los pacientes bien controlados con Somatuline 30 mg cada 14 días pueden ser tratados con SOMATULINE® AUTOGEL® 120 mg cada 56 días y los pacientes bien controlados con Somatuline 30 mg cada 10 días pueden ser tratados con SOMATULINE® AUTOGEL® 120 mg cada 42 días. A partir de ahí, la dosis debe ser calculada para cada individuo dependiendo de la respuesta del paciente (evaluada por la mejora de los síntomas y/o la reducción de los niveles de GH y/o IGF1).
Si no se alcanza la respuesta deseada, la dosis puede aumentarse a 120 mg cada 28 días.
La dosis puede reducirse, si se obtiene el control total de los parámetros clínicos (niveles de GH por debajo de 1 ng/mL, niveles normales de IGFI y desaparición de los síntomas).
El médico determinará la frecuencia con que deben controlarse los síntomas y los niveles de GH e IGFI, dependiendo de la condición clínica del paciente. Si el paciente está esperando por una cirugía, el régimen de administración es de una inyección subcutánea profunda de SOMATULINE® AUTOGEL® 90 mg cada 28 días.
En pacientes bien controlados con Lanreotida, SOMATULINE® AUTOGEL® 120 mg se puede administrar cada 42 o 56 días. Por ejemplo, los pacientes bien controlados con SOMATULINE® AUTOGEL® 60 mg inyectado cada 28 días, pueden ser tratados con SOMATULINE® AUTOGEL® 120 mg cada 56 días y los pacientes bien controlados con SOMATULINE® AUTOGEL® 90 mg inyectado cada 28 días, pueden ser tratados con SOMATULINE® AUTOGEL® 120 mg cada 42 días.
Tratamiento de los síntomas clínicos asociados con tumores neuroendocrinos: La dosis inicial recomendada es de 60 a 120 mg administrados cada 28 días. La dosis se ajustará según la mejoría observada.
Tratamiento de tumores neuroendocrinos gastroenteropancreáticos en pacientes adultos con enfermedad metastásica o localmente avanzada no resecable: La dosis recomendada de SOMATULINE® AUTOGEL® es una inyección de 120 mg administrada cada 28 días. El tratamiento con SOMATULINE® AUTOGEL® debe continuar tanto como se necesite para el control del tumor.
Pacientes con insuficiencia hepática/renal: En pacientes con insuficiencia renal o hepática no se necesita ningún ajuste de dosis, debido al amplio rango terapéutico de la Lanreotida (ver sección Propiedades farmacocinéticas).
Pacientes de edad avanzada: En ancianos, no es necesario ajustar la dosis debido al amplio rango terapéutico de la Lanreotida (ver sección Propiedades farmacocinéticas).
Niños y adolescentes: No se recomienda el uso de la Somatuline® Autogel en niños o adolescentes debido a la falta de datos de seguridad y eficacia.
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN: Las jeringas prellenadas de SOMATULINE® AUTOGEL® están disponibles en concentraciones de dosis de 60 mg, 90 mg, y 120 mg.
SOBREDOSIS: En caso de sobredosis, se indica tratamiento sintomático.
Ante la eventualidad de una sobredosificación concurrir al Hospital más cercano o comunicarse con los Centros de Toxicología (para Argentina, Chile y Uruguay léanse al final del prospecto).
PRESENTACIONES: Envases con 1 jeringa prellenada. SOMATULINE® AUTOGEL® 60 mg (Reg. San. No. INVIMA 2015M-0003333-R1
SOMATULINE® AUTOGEL® 90 mg (Reg. San. No. INVIMA 2014M-0003573-R1).
SOMATULINE® AUTOGEL® 120 mg (Reg. San. No. INVIMA 2008M-0008625).
MANTENER TODOS LOS MEDICAMENTOS FUERA DEL ALCANCE DE LOS NIÑOS.
Elaborado por: IPSEN PHARMA BIOTECH, Parc D’Activités du Plateau de Signes CD N° 402, 83870, Signes, Francia
Sanofi-Aventis de Colombia S.A., Bogotá.
SmPC 2015
Última revisión: Marzo 2015
Importado y Distribuido por:
SANOFI-AVENTIS DE COLOMBIA S. A.
Transversal 23 No. 97-73, Pisos 8 y 9
Teléfono: 6214400, Fax: 7444237
Bogotá, D.C., Colombia
CONSERVACIÓN: Consérvese en su envase original en heladera/ refrigerador (2 °C - 8 °C). No congelar.
Después de abrir el producto por primera vez, utilizarlo inmediatamente.
Precauciones especiales para el descarte y otras condiciones de manipulación
La solución para inyección en jeringas prellenadas viene lista para ser utilizada.
Para uso único e inmediato después de abrir el producto por primera vez.
No debe utilizarse después de la fecha de vencimiento indicada en el envase.
No utilice si la cubierta laminada está dañada o abierta.
Cualquier producto no usado o material de desecho debe eliminarse de acuerdo con las exigencias locales.
Es importante que la inyección del producto se haga exactamente de acuerdo con las instrucciones del prospecto.